Elektrokimia merupakan salah satu cabang ilmu kimia yang mempelajari peristiwa yang berhubungan dengan listrik dan aliran elektron dalam
arti reaksi kimia. Ilmu ini memiliki sangat banyak manfaat dalam kehidupan, sebagai contoh elektrokimia adalah prinsip yang diterapkan dalam semua jenis baterai yang digunakan oleh manusia pada smartphone, laptop, dan lain-lain.Elektrokimia pada dasarnya akan senantiasa melibatkan reaksi redoks (reduksi oksidasi). Dengan demikianlah, pada artikel ini akan dibahas tentang apa itu elektrokimia, jenis hukum faraday, dan juga contoh soal yang kerapkali muncul dalam ujian.
Elektrokimia
Elektrokimia adalah studi mengenai hubungan antara reaksi kimia dan listrik yang menyertainya. Hal ini termasuk studi tentang arti perubahan kimia yang disebabkan karena keberadaan arus listrik ataupun produksi energi listrik oleh reaksi kimia tertentu.
Pengertian Elektrokimia
Definisi elektrokimia adalah serangkaian pemisahan muatan yang terjadi di dalam media cair sperti larutan. Pemisahan larutan homogen dengan elektrokimia menerapkan prinsip dari reaksi oksidasi dan reaksi reduksi dimana salah satu zat yang dipisahkan nantinya akan mengalami pengendapan menjadi bentuk padatan sehingga dapat dipisahkan dari larutannya. Dalam elektrokimia juga melibatkan dua buah elektroda penghantar yaitu anoda dan katoda.
Pertukaran antara energi listrik dan reaksi kimia memiliki aplikasi yang sangat luas dalam kehidupan manusia seperti penerapan pada prinsip kerja baterai yang memberi daya pada smartphone anda saat ini. Prinsip yang digunakan pada baterai juga menerapkan reaksi redoks dimana oksidasi menyebabkan hilangnya satu atau lebih elektron pada satu spesies kimia sedangkan reduksi adalah penambahan satu atau lebih elektron dalam satu spesies kimia.
Ketika reaksi oksidasi dan reduksi dipasangkan bersama dalam suatu reaksi redoks, elektron dapat mengalir dari spesies ter-oksidasi ke spesies ter-reduksi. Aliran elektron tersebut dapat secara spontan dihasilkan oleh reaksi dan menyebabkan energi listrik dalam satu sel. Hal itulah yang dimanfaatkan pada prinsip kerja baterai yang ada hingga saat ini.
Jenis Sel Elektrokimia
Terdapat dua jenis sel elektrokimia yaitu sel volta dan sel elektrolisis. Berikut ini merupakan penjelasan kedua jenis sel elektrokimia secara lengkap;
Sel Volta
Sel volta atau dikenal sebagai sel galvanik merupakan sel elektrokimia yang pertama kali ditemukan pada tahun 1800-an oleh Alessandro Volta dan Luigi Galvani. Hingga saat ini, sel volta ini telah berkembang menjadi komponen baterai seperti yang sudah dibahas sebelumnya.
Dalam pengertiannya, sel volta adalah sel elektrokimia yang didalamnya terjadi reaksi kimia yang menghasilkan energi listrik proporsional.
Sel volta memiliki prinsip kerja yaitu ketika dua plat logam yang berbeda sebagai elektroda secara bersamaan direndam dalam larutan elektrolit yang memiliki reaktivitas lebih tinggi dengan plat tersebut, maka hal ini akan menyebabkan ion logam didalamnya larut sebagai ion bermuatan positif dan meninggalkan elektron bebas pada plat, oleh karena itu plat logam menjadi bermuatan negatif.
Pada plat logam yang lain dimana reaktivitasnya lebih rendah akan cenderung menarik ion positif yang ada pada larutan elektrolit untuk menempel pada permukaannya sehingga menyebabkan plat ini menjadi bermuatan positif. Jika kedua plat ini terhubung melalui sebuah konduktor, maka elektron akan mengalir dan menyebabkan arus listrik terbentuk mengalir melaluinya.
Besar arus listrik yang dihasilkan akan sebanding dengan jumlah muatan positif dan negatif yang ada pada masing-masing plat logam.
Berikut ini merupakan contoh penerapan sel volta;
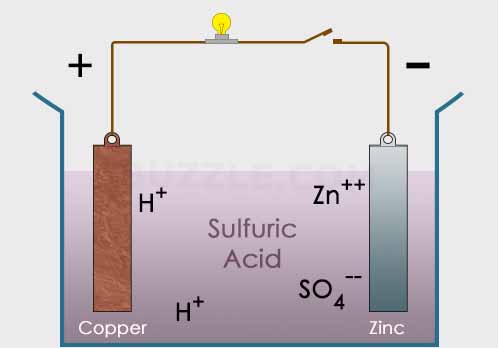
Gambar tersebut menunjukkan sel volta sederhana dimana asam sulfat H2SO4 menjadi larutan elektrolit dalam reaksi tersebut. Sedangkan dua logam sebagai elektroda yaitu zinc (Zn) dan juga tembaga (Cu). Kedua elektroda tersebut dihubungkan dengan sebuah konduktor yang terdapat lampu untuk membuktikan keberadaan arus listrik.
Reaksi yang terjadi dalam sel
Pada larutan : H2SO4 –> 2H+ + SO42-
Pada larutan : Zn2+ + SO42- –> ZnSO4
Pada elektroda Zn : Zn –> Zn2+ + 2 e–
Pada elektroda Cu : 2H+ + 2e– –> H2 (gas)
Logam Zn memiliki potensial reduksi sebesar -0.62 V sedangkan logam Cu memiliki potensial reduksi sebesar 0.46 sehingga total potensial listrik yang dihasilkan oleh sel tersebut adalah 0.46-(-0.62) = 1.08 V. Dengan logam Zn mengalami oksidasi sedangkan Cu mengalami reduksi.
Reaksi redoks spontan yang menghasilkan energi listrik ini disebut sel volta atau sel sel galvanik, diambil dari nama ilmuwan Italia Luigi Galvani dan Alessandro Volta, yang membuat sel ini untuk pertama kali. Reaksi redoks dapat menghasilkan listrik sebab pada reaksi redoks terjadi pemindahan elektron dari reduktor ke oksidator. Hal ini dapat diterangkan dengan gambar sel volta berikut:

Zink (Zn) mengalami oksidasi sehingga Zn melepaskan 2 elektronnya, tembaga (Cu) mengalami reduksi (pengikatan elektron) dengan demikian elektron yang dihasilkan oleh Zn diikat oleh Cu. Logam seng dan tembaga dimana terjadi reaksi redoks tersebut disebut elektode/elektroda. Elektrode tempat terjadinya oksidasi disebut anode/anoda, sedangkan tempat terjadinya reduksi disebut katode/katoda. Oleh karena oksidasi adalah pelepasan elektron maka anode adalah kutub negatif, sedangkan katode kutub positif. Selanjutnya ada kesepakatan untuk menuliskan notasi sel/lambang /diagram sel elektrokimia sebagai berikut:
Zn | Zn2+ || Cu2+ | Cu
Anoda Katode
I : menyatakan perubahan zat pada anoda Zn mengalami oksidasi menjadi Zn2+ pada katoda Cu2+ menjadi Cu
II : menyatakan jembatan garam.
1. Potensial Elektroda
Jika suatu logam kita celupkan dalam air maka akan timbul beda potensial antara batang logam dan air yang kita sebut potensial elektroda. Setiap logam memiliki potensial elektroda yang berbeda-beda. Jika dua sistem elektroda dihubungkan akan terjadi arus listrik karena terjadi perpindahan elektron dari anoda menuju katoda.
Dalam menentukan besarnya potensial elektroda tunggal secara langsung sangat sulit. Diperlukan elektroda pembanding yang memiliki harga potensial elektroda nol, sehingga harga potensial elektrode yang lain dapat ditentukan dengan voltmeter. Elektroda pembanding yang digunakan untuk menghitung besarnya potensial elektroda logam adalah elektroda Hidrogen. Potensial sel yang dihasilkan oleh suatu elektroda dengan elektrode hidrogen disebut potensial elektrode itu dan diberi lambang E. Apabila diukur pada keadaan standar (250 C, dengan konsentrasi 1 M dan tekanan gas 1atm), disebut potensial elektrode standar dan diberi lambang E0 .
2 H+ (1 M) + 2 e ---------> H2(g) (1 atm) E0 = 0 volt
Elektrode yang lebih mudah mengalami reduksi dibandingkan terhadap elektrode hidrogen mempunyai potensial elektrode bertanda positif, sedangkan elektrode yang lebih sukar mengalami reduksi dibandingkan terhadap elektrode hidrogen mempunyai potensial elektrode bertanda negatif. Menurut kesepakatan potensial elektrode dikaitkan dengan reaksi reduksi. Jadi potensial elektrode sama dengan potensial reduksinya. Harga E0 tidak mengalami perubahan apabila reaksi tersebut diubah arahnya karena potensial merupakan sifat intrinsik.
2. Potensial Sel
Potensial sel volta dapat ditentukan melalui percobaan dengan menggunakan voltmeter / potensiometer dan dihitung berdasarkan data potensial elektrode positif (katode) dan potensial elektrode negatif (anode).
E0sel = E0(+) – E0(-)
Suatu susunan sel dapat (berlangsung) menghasilkan energi listrik atau tidak tergantung susunan yang kita buat. Suatu sel dapat berlangsung apabila harga potensial selnya bernilai positif. Cara menentukan susunan sel volta dengan melihat harga potensial elektrodanya, apabila potensial elektrodanya positif maka logam tersebut sebagai katoda sedang logam lainnya sebagai anoda.
Contoh soal : tentukan reaksi sel dan potensial elektroda jika diketahui,
harga potensial : Cu2+ + 2e ----------> Cu E0 = + 0,34 volt
Ag+ + e -----------> Ag E0 = + 0,80 volt
Jawab : karena Ag memiliki harga potensial elektroda lebih positif, maka Ag sebagai katoda mengalami reaksi reduksi sedangkan Cu sebagai anoda.
Katoda : Ag+ + e -------> Ag ) dikali 2 E0 = + 0,80 volt
Anoda : Cu -------> Cu2+ + 2e ) dikali 1 E0 = + 0,34 volt
2Ag+ + Cu --------> Cu2+ + 2 Ag E0sel = +0,46 volt
E0sel = E0(+) – E0(-)
= 0,80 volt – 0,34volt
= + 0,46 volt
3. Beberapa Sel Volta komersial
Pada sel volta komersil ada 2 jenis sel, yaitu sel yang dapa diisi ulang yang disebut sebagai sel volta sekunder dan yang tida dapat diisi ulang yaitu sel volta primer.
- Accumulator (Aki)
Sel aki terdiri atas anoda timbal (Pb) dan katoda timbal dioksida (PbO2) yang dicelupkan kedalam larutan elektrolit H2SO4. kedua eletrode dan hasil reaksinya tidak larut dalam H2SO4 sehingga tidak diperlukan adanya jembatan garam.

Reaksi pengosongan aki:
Anode : Pb(s) + HSO4–(aq) --------> PbSO4(s) + H+(aq) + 2e
Katode: PbO2(s) + HSO4–(aq) + 3H+(aq) + 2e --------> PbSO4(s) + 2 H2O
Pb(s) + PbO2(s) + 2 HSO4–(aq) + 2H+ --------> 2PbSO4(s) + 2 H2O
Tiap sel aki mempunyai beda potensial kurang lebih 2 Volt, aki 12 V terdiri atas 6 sel yang dihubungkan seri. Dua hal yang perlu diperhatikan dari reaksi pengosongan aki:
- anode dan katode berubah menjadi zat yang sama sehingga tidak ada beda potensial.
- selama pengosongan aki H2SO4 diikat dan dihasil air, sehingga kadar H2SO4 berkurang.
Aki dapat diisi kembali karena hasil-hasil reaksi pengosongan aki tetap melekat pada kedua elektrode. Pengisian aki dapat dilakukan dengan membalik arah aliran elektron pada kedua elektrode.
Reaksi pengisian aki sebagai berikut:
Anode (PbO2) : PbSO4(s) + 2 H2O(l) --------> PbO2(s) + HSO4–(aq) + 3H+(aq) + 2e
Katode (Pb) : PbSO4(s) + H+(aq) + 2e --------> Pb(s) + HSO4–(aq)
2PbSO4(s) + 2 H2O --------> Pb(s) + PbO2(s) + 2 HSO4–(aq) + 2H+
2. Baterai Kering (Sel Leclanche)
Sel Leclanche terdiri atas suatu silinder seng yang berisi pasta dari batu kawi (MnO2) , salmiak (NH4Cl) Carbon dan sedikit air. Seng berfungsi sebagai anode sedangkan katodenya carbon. Yang dicelupkan ke dalam pasta yang berfungsi sebagai oksidator. Reaksinya secara garis besar dituliskan sebagai berikut:
Anode : Zn(s) --------> Zn2+(aq) + 2e
Katode: 2MnO2(s) + 2 NH4+(aq) + 2e --------> Mn2O3(s) + 2 NH3(aq) + H2O(l)
Zn(s) + 2MnO2(s) + 2 NH4+(aq) --------> Zn2+(aq) + Mn2O3(s) + 2 NH3(aq) + H2O(l)
Zn2+ yang terbentuk mengikat NH3 membentuk ion Zn (NH3)42+. Reaksinya tidak dapat dibalik sehingga baterai jenis ini tidak dapat diisi ulang.

Baterai kering jenis alkaline pada dasarnya sama dengan baterai kering biasa tapi bersifat basa, karena menggunakan KOH dalam pastanya.
3. Baterai Nikel-Kadmium
Baterai Nikel-Kadmium adalah baterai kering yang dapat diisi kembali. Reaksi selnya:
Anode : Cd(s) + 2 OH–(aq) --------> Cd(OH)2(s) + 2e
Katode : NiO2(S) + 2 H2O(l) + 2e --------> Ni(OH)2(s) + 2 OH–(aq)
Cd(s) + NiO2(S) + 2 H2O(l) --------> Cd(OH)2(s) + Ni(OH)2(s)
Hasil-hasil reaksi baterai Nikel-Kadmium merupakan zat padat yang melekat pada kedua elektroda, sehingga dengan membalik arah elektron maka zat tersebut dapat diubah menjadi zat semula.
4. Baterai Litium
Baterai litium merupakan salah satu alat penyimpan energi tercanggih saat ini. Karena selain tahan lama, baterai ini mempunyai kemampuan yang tinggi dalam menyimpan energi dan ramah lingkungan serta dapat diisi ulang. Baterai litium yang digunakan menggunakan bahan dasar polimer. Jenis polimer yang digunakan PEO (polyetilen Oxalate) untuk komposit elektroda dan PVDF (Polyvinyl Diflouride) untuk komposit elektrolitnya.
Karena bahan polimer tersebut mahal, maka di Indonesia lembaran katodanya digantikan dengan Litium Mangan Oxide, lembaran anoda digantikan dengan grafit, sedangkan elektrolitnya digantikan dengan Litium Titanium Alumunium Phospate.

- Sel Bahan Bakar
Sel bahan bakar adalah sel yang menggunakan bahan bakar campuran hidrogen dengan oksigen atau campuran gas alam dengan oksigen. Sel bahan bakar ini akan tetap memberikan energi bila bahan bakarnya diisi terus menerus. Reaksi selnya sebagai berikut:
Anode : 2 H2(g) + 4 OH–(aq) --------> 4 H2O(l) + 4 e
Katode: O2(g) + 2 H2O(l) + 4 e --------> 4 OH–(aq)
2 H2(g) + O2(g) --------> 2 H2O(l)
Sel seperti ini digunakan untuk sumber listrik pada pesawat ruang angkasa. Selain itu hasil dari sel ini dapat digunakan sebagai sumber air di luar angkasa.
Sel Elektrolisis
Sel elektrolisis adalah jenis lain dari sel elektrokimia dimana sel elektrolisis ini bekerja dengan prinsip yang berlawanan dengan sel volta. Sel elektrolisis merupakan sel elektrokimia yang mendorong terjadinya reaksi kimia dengan adanya aliran listrik di dalamnya.
Sel elektrolisis bekerja dengan digunakan juga dua elektroda yang direndam dalam larutan elektrolit dimana kedua elektroda yang digunakan memiliki perbedaan potensial dengan adanya sumber listrik sehingga menyebabkan salah satu elektroda bermuatan positif sedangkan satu yang lainnya bermuatan negatif.
Adanya listrik menyebabkan usur elektrolit cair dipecah menjadi ion positif dan ion negatif dimana ion negatif akan tertarik ke dalam elektroda positif sedangkan ion positif akan diendapkan menjadi padatan yang menempel pada elektroda yang bermuatan negatif. Dengan prinsip demikian, sel elektrolisis dapat digunakan dalam pemisahan suatu zat dari senyawa tertentu.
Berikut ini contoh dari sel elektrolisis;
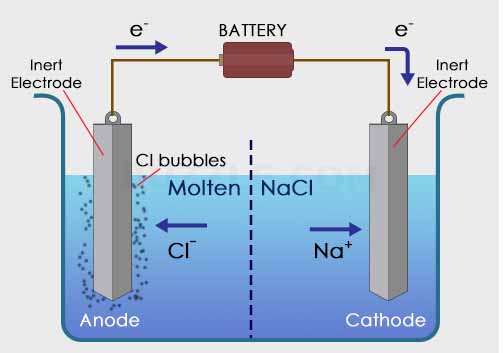
Digunakan larutan NaCl sebalai larutan elektrolit dan dua buah elektroda sebagai anoda dan katoda serta dialiri oleh listrik melalui sebuah baterai. Ketika arus listrik dialirkan, maka elektroda akan bermuatan positif dan negatif. Elektroda positif akan menarik ion Cl– dalam larutan, sedangkan elektroda negatif akan menarik ion Na+ dalam larutan NaCl.
Reaksi yang terjadi dalam sel elektrolisis
Pada katoda : Na+ + e– –> Na (endapan)
Pada anoda : 2Cl– –> + Cl2 + e–
Total reaksi : 2 NaCl –> 2Na (padat) + Cl2 (gas)
Elektrolisis menimbulkan reaksi redoks dan banyaknya zat yang dihasilkan berbanding lurus dengan jumlah muatan listrik yang mengalir dalam sel elektrolisis. Reaksi elektrolisis tergolong reaksi redoks tidak spontan. Reaksi ini dapat berlangsung karena pengaruh energi listrik. Jadi pada elektrolisis terjadi perubahan energi listrik menjadi energi kimia.
Susunan sel elektrolisis digambarkan sebagai berikut:
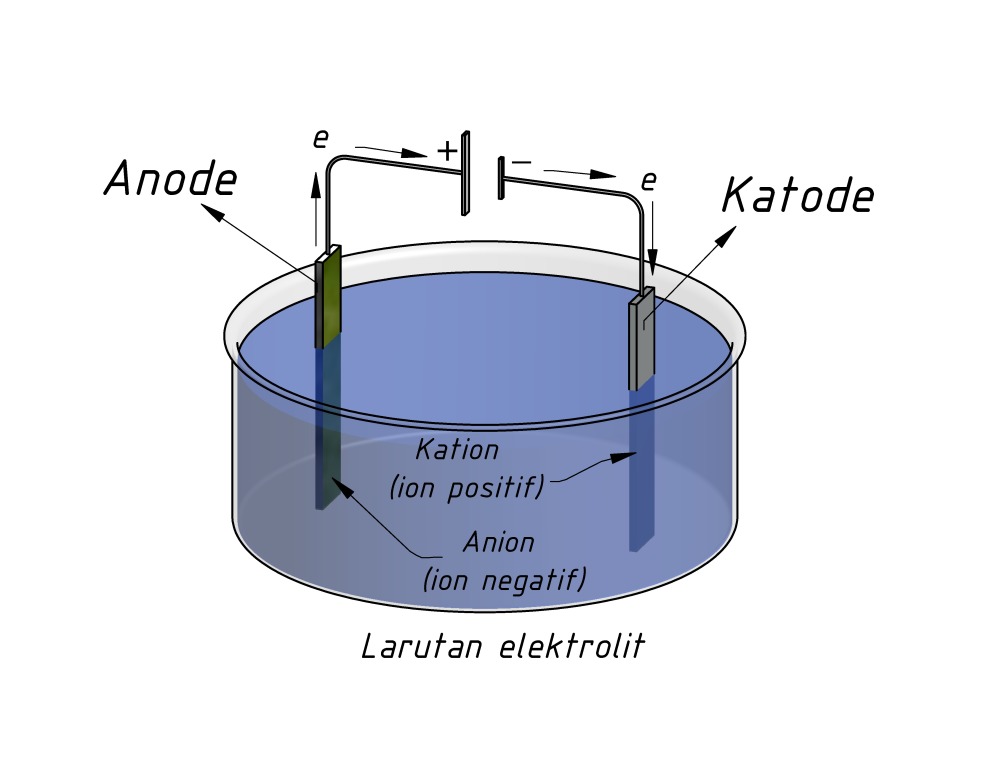
- Reaksi-reaksi elektrolisis
Reaksi di katode bergantung pada jenis kation (kationnya apa?)
- Kation logam aktif ( golongan I A,IIA, Al dan Mn), maka air yang tereduksi.
2H2O(l) + 2e --------> H2(g) + 2OH–(aq)
Catatan: Kation logam aktif dalah fase lelehan/leburan dapat mengalami reduksi.
IA: Li,Na,K,Rb,Cs
IIA: Be, Mg , Ca, Ba, Ra
2. kation lain mengalami reduksi
2H+(aq) + 2e --------> H2(g)
Lx+(aq) + xe --------> L(s)
Reaksi di anode bergantung pada jenis anoda/elektroda dan anion.
- (Anoda/elektrodanya apa?)
Jika Anoda/elektrodanya inert (Pt, Au,C) maka yang mengalami oksidasi anionnya,(anionnya apa) dengan melihat jika :
1). Anion merupakan sisa asam oksi(sisa asam yang mengandung oksigen, SO42-, PO42-, dll), maka air mengalami oksidasi: 2 H2O(l) 4 H+(aq) + O2(g) + 4e
2). Sisa asam yang lain (Br–, Cl–, I–) atau OH– teroksidasi
Contoh: 2 Br–(aq) --------> Br2(g) + 2e
4OH–(aq) --------> 2 H2O(l) + O2(g) + 4e
Jika Anoda/elektrodanya tidak inert ,maka elektroda mengalami oksidasi
L(s) --------> Lx+(aq) + x e
Fe(s) --------> Fe2+(aq) + 2 e
Contoh:
1.Elektrolisis larutan NaOH dengan elektrode grafit(C)
NaOH --------> Na+ + OH–
Reaksi di katoda tergantung pada kationnya, karena Na+ merupakan logam akif golongan IA maka yang mengalami reduksi adalah air,
Katode : 2 H2O(l) + 2e --------> H2(g) + 2 OH–(aq)
Pada reaksi di anoda pertama kita lihat anoda/elektrode. C merupakan elektroda aktif selanjutnya kita lihat anionnya OH–, bukan asam oksi sehingga OH– sendiri yang mengalami oksidasi.
Anode : 4OH–(aq) --------> 2 H2O(l) + O2(g) + 4e
Kedua reaksi diatas selanjutnya kita jumlahkan
Katode : 2 H2O(l) + 2e --------> H2(g) + 2 OH–(aq)
Anode : 4OH–(aq) --------> 2 H2O(l) + O2(g) + 4e
2 H2O(l) --------> 2 H2(g) + O2(g)
2.Elektrolisis larutan ZnSO4 dengan elektrode tembaga
ZnSO4 --------> Zn2+ + SO42-
Reaksi di katoda tergantung pada kationnya, Zn2+ bukan logam aktif (IA, IIA), maka Zn2+ dapat mengalami reduksi.
Katode : Zn2+ + 2e --------> Zn
Pada reaksi di anoda pertama kita lihat anoda/elektrode. Tembaga bukan termasuk elektroda inert, maka tembaga mengalami oksidasi.
Anode : Cu --------> Cu2+ + 2e
Kedua reaksi diatas selanjutnya kita jumlahkan
Katode : Zn2+ + 2e --------> Zn
Anode : Cu --------> Cu2+ + 2e
Zn2+ + Cu --------> Zn + Cu2+
3.Penggunaan elektrolisis dalam industri
a. Produksi zat
Banyak zat kimia dibuat melalui elektrolisis misalnya logam-logam alkali, magnesium, alumunium, fluorin, klorin, natrium hidroksida, natrium hipoklorit dan hidrogen peroksida. Secara industri klorin dan natrium hidroksida dibuat dari elektrolisis larutan NaCl dengan reaksi sebagai berikut:
NaCl(aq) --------> Na+(aq) + Cl–(aq)
Katode : 2 H2O(l) + 2e --------> 2 OH–(aq) + H2(g)
Anode : 2Cl–(aq) --------> Cl2(g) + 2e
2 H2O(l) + 2Cl–(aq) --------> 2 OH–(aq) + H2(g) + Cl2(g)
reaksi rumusnya : 2 H2O(l) + 2 NaCl(aq) --------> 2NaOH(aq) + H2(g) + Cl2(g)
b.Pemurnian logam
Untuk membuat kabel listrik diperlukan tembaga murni,sebab adanya pengotor dapat mengurangi konduktivitas tembaga. Tembaga dimurnikan secara elektrolisis, tembaga kotor di anode dan tembaga murni di katodenya. Larutan elektrolit yang digunakan adalah larutan CuSO4.
CuSO4(aq) --------> Cu2+(aq) + SO42-(aq)
Katode : Cu2+(aq) + 2e --------> Cu(s)
Anode : Cu(s) --------> Cu2+(aq) + 2e
Cu(s) dianode --------> Cu(s) dikatode
c.Pelapisan (electroplating)
Pelapisan dimaksudkan untuk melindungi logam terhadap korosi atau untuk memperbaiki penampilan barang tersebut. Misalnya saja pelapisan body mobil atau motor,pelapisan perhiasan dan pelapisan perabot rumah tangga. Pada pelapisan logam yang akan disepuh dijadikan katode sedangkan anodenya adalah logam yang digunakan untuk menyepuh, larutan elektrolitnya adalah garam dari logam penyepuh. Contoh: pelapisan sendok dengan logam perak, larutan elektrolit yang digunakan AgNO3 atau AgCl. Reaksinya sebagai berikut:
AgNO3(aq) --------> Ag+(aq) + NO3–(aq)
Katode (sendok) : Ag+(aq) + e --------> Ag(s)
Anode (Ag) : Ag(s) --------> Ag+(aq) + e
Ag(s) anode --------> Ag(s) sendok
Perbedaan Sel Volta dan Sel Elektrolisis
Adapun untuk memperjelas, berikut ini adalah perbedaan yang ada dalam sel volta dan elektrolisisnya. Antara lain;
Sel Volta
- Reaksi kimia menghasilkan energi listrik
- Digunakan 2 elektroda logam berbeda
- Anoda bermuatan negatif, katoda bermuatan positif
- Reaksi spontan
Sel Elektrolisis
- Energi listrik menghasilkan reaksi kimia
- Digunakan 2 elektroda inert yang sama
- Anoda bermuatan positif, katoda bermuatan negatif
- Reaksi tidak spontan
Hukum Faraday
Hubungan antara jumlah muatan listrik yang melewati suatu larutan elektrolit dan jumlah zat yang terdapat dalam elektroda dinyatakan oleh Faraday pada tahun 1834 dalam suatu hokum elektrolisis. Hukum Faraday pertama menyatakan bahwa massa suatu zat yang diendapkan atau dibebaskan di setiap elektroda berbanding lurus dengan jumlah muatan yang terlibat.
Dalam hukum kedua Faraday menyatakan bahwa massa suatu zat yang diendapkan atau dibebaskan pada elektroda berbanding lurus dengan muatan yang melaluinya. Secara persamaan matematis, hukum Faraday dapat diperoleh persamaan berikut:
w = (e I t) / F
Dimana w adalah massa zat yang diendapkan dalam gram, e adalah massa ekuivalen (Mr/valensi), I adalah kuat arus dalam ampere, t adalah waktu dalam second, sedangkan F adalah tetapan Faraday (96.500 coloumb).
-------------------------------------------------------------------------------------------------------
Latihan Soal
- Diketahui potensial elektroda :
Mg2+ + 2e --------> Mg E0 = – 2,37 volt
Zn2+ + 2e --------> Zn E0 = – 0,76 volt
Li+ + e --------> Li E0 = – 3,04 volt
Cr3+ + 3e --------> Cr E0 = – 0,74 volta
a. Tuliskan 2 reaksi sel yang dapat berlangsung!
b. Tuliskan notasi / diagram selnya!
2. Diketahui potensial elektroda :
Ba2+ + 2e --------> Ba E0 = – 2,90 volt
Mn2+ + 2e --------> Mn E0 = -1,18 volt
Cr3+ + 3e --------> Cr E0 = – 0,74 volt
Pb2+ + 2e --------> Pb E0 = -0,13 volt
Apakah reaksi berikut dapat berlangsung spontan
- Mn2+ + Pb --------> Mn + Pb2+
- 2 Cr3+ + 3 Ba --------> 3 Ba2+ + 2 Cr
3. Tuliskan reaksi elektrolisis larutan berikut:
- larutan AgNO3 dengan elektroda grafit
- Larutan Ba(OH)2 dengan elektroda Zn
- Larutan HBr dengan elektroda platina
- Lelehan BaCl2 dengan elektroda grafit
- Larutan Na2SO4 dengan elektroda grafit
4. Larutan Cu(NO3)2 dielektrolisis selama 3 menit dengan arus 96,5 Ampere. Hitunglah massa tembaga yang akan mengendap di katodanya!
5. Elektrolisis larutan AgNO3 dihubungkan seri dengan larutan ZnSO4. Bila diperoleh 2 gram endapan Zn. Berapa gram endapan perak yang dihasilkan? (Ar Ag=108 Zn=65)
6. Pada proses pelapisan besi dengan zink hitung arus yang harus digunakan apabila massa yang diinginkan 5 gran dan elektrolisis berlangsung selama 15 menit!
7. Joti ingin melapisi cincin seng dengan perak. Tentukan larutan yang harus digunakan?apa reaksi kimia yang terjadi?katoda dan anoda?













0 komentar:
Posting Komentar